Una svolta per il trattamento di leucemie e linfomi. Grazie allo sviluppo di un farmaco di precisione, è possibile bloccare l’effetto negativo prodotto dal danno del DNA che è presente nella cellula leucemica. L’utilizzo dei nuovi farmaci di precisione può essere determinante in ogni fase della malattia: nel trattamento iniziale di alcuni sottogruppi e nelle malattie più resistenti.
SCARICA LA SCHEDA PROGETTO
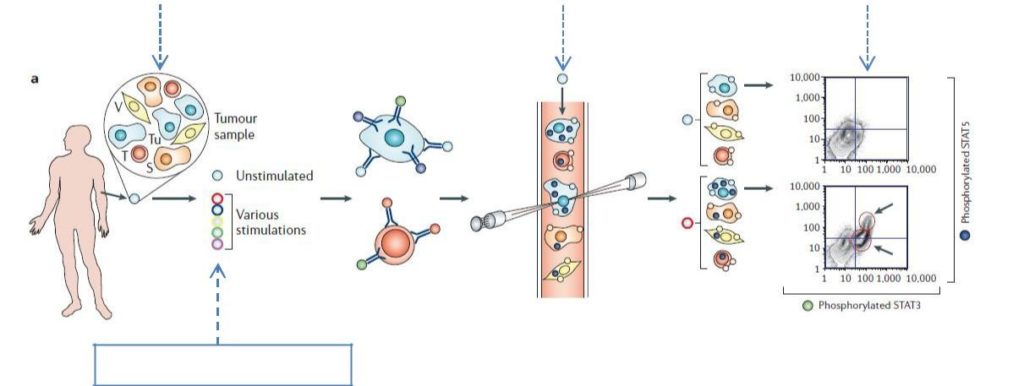
La Leucemia Linfoblastica Acuta (LLA) è la più frequente forma tumorale dell’età pediatrica che ha visto molti progressi nella cura negli ultimi decenni, nonostante ciò una parte dei pazienti non risponde ancora adeguatamente alla terapia.
Questo differente esito clinico individuale può essere dovuto alle specifiche alterazioni genetiche che caratterizzano ogni paziente e che si traducono in una alterazione dei meccanismi funzionali delle cellule leucemiche che in ultima analisi determinano la loro sensibilità verso i farmaci.
La comprensione dei meccanismi responsabili delle forme resistenti e recidivanti di malattia rappresenta oggi una delle sfide più rilevanti della ricerca nel campo della LLA in età pediatrica, ed è oggi possibile grazie alla disponibilità di strumentazioni e programmi informatici di nuova generazione in grado di indagare il comportamento della leucemia a livello di singola cellula, con l’obiettivo di:
Questo tipo di indagine può essere applicato a sottogruppi di pazienti caratterizzati da una precisa lesione genetica (o da un insieme di lesioni genetiche che cooperano tra loro), oppure può essere applicato a un insieme geneticamente eterogeneo di pazienti per individuarne caratteristiche funzionali comuni.
Recentemente abbiamo dimostrato che lo studio a livello di singola cellula puo’ essere applicato anche alle cellule leucemiche prelevate durante terapia, (e non solo a quelle raccolte all’esordio della malattia). Questo approccio, sebbene complicato dalla scarsa numerosità delle cellule residue dopo il trattamento, è di notevole interesse poiché ci consentirà di studiare il comportamento cellulare al netto del trattamento subito in vivo (nell’organismo del paziente), offrendoci la possibilità di osservare quali molecole sono attivate o dis-attivate a seguito della terapia.
Il passaggio successivo sarà quello di testare in vitro (cioè in laboratorio) ed in vivo (su modelli pre-clinici) i farmaci di nuova generazione che potrebbero essere efficaci sulle molecole responsabili della resistenza.
Quando parliamo di farmaci di nuova generazione intendiamo principalmente due tipologie di molecole:
Gli Inibitori: molecole in grado di spegnere una funzione specifica della cellula.
Gli Anticorpi monoclonali: molecole derivate dal sistema immunitario che possono riconoscere in modo specifico gli antigeni tumorali. Questi anticorpi possono oggi essere opportunamente “ingegnerizzati” per scatenare una reazione cito-tossica specifica sulla cellula tumorale con una modalità diretta, oppure reclutando il sistema immunitario del paziente che grazie all’anticorpo può esercitare la sua azione di difesa in modo molto più efficiente.
Project Leader: Dott. Giuseppe Gaipa
Direttore tecnico Laboratorio Stefano Verri
SCARICA LA SCHEDA PROGETTO
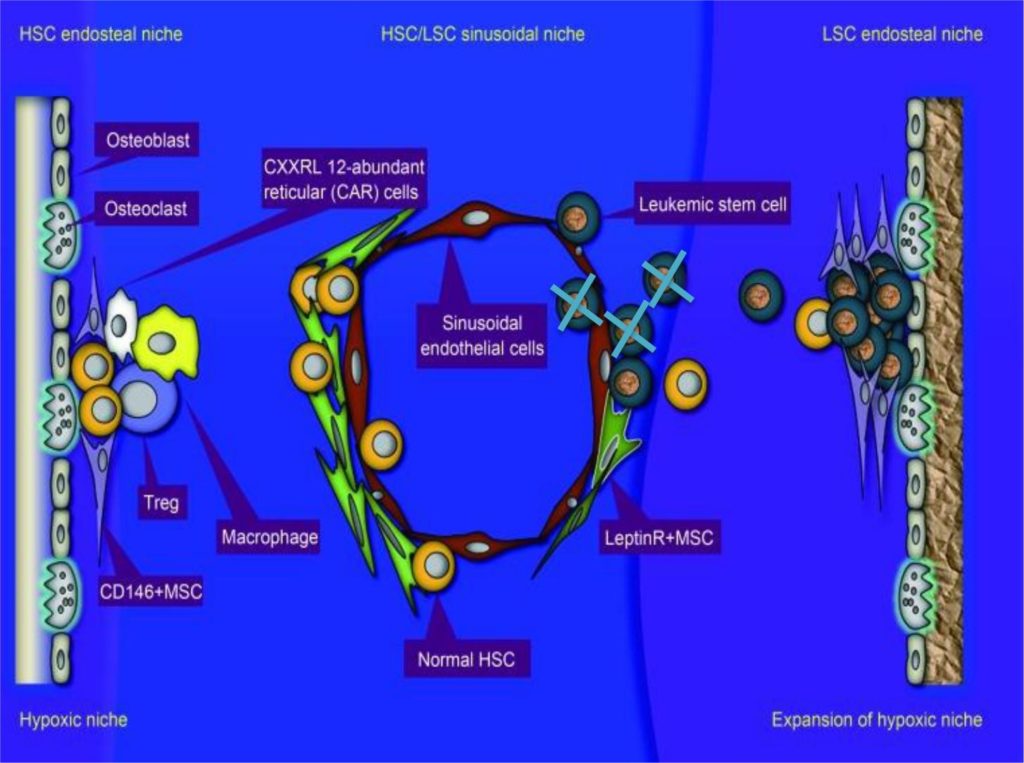
Le cellule staminali sono cellule capostipiti di una discendenza cellulare e risiedono in una determinata regione del nostro corpo, che viene definita con il termine “nicchia”. Ogni tipologia di cellula staminale, quindi, risiede nella sua nicchia. In particolare, le cellule staminali ematopoietiche si trovano nella nicchia staminale del midollo osseo.
In laboratorio siamo riusciti a costruire un modello di nicchia ematopoietica che mima fedelmente l’architettura di questa regione e ne contiene tutti i caratteristici elementi strutturali.
Nella nicchia ematopoietica di un soggetto normale sono contenute le cellule staminali ematopoietiche, che hanno il compito di generare tutte le cellule appartenenti al sistema emopoietico.
Nel caso della leucemia, è stato ipotizzato che le cellule staminali leucemiche vadano a rintanarsi all’interno del midollo osseo, proprio nella stessa nicchia che accoglie e protegge le cellule staminali sane. Queste cellule staminali leucemiche sono responsabili di generare la leucemia stessa e sono particolarmente resistenti alle terapie convenzionali perché proliferano poco o non proliferano.
Il principale obiettivo del progetto è studiare la leucemia mieloide acuta, a partire dall’interazione delle cellule staminali leucemiche con il microambiente del midollo osseo in cui risiedono, e testare quali farmaci di nuova tecnologia siano in grado di colpire le cellule staminali leucemiche all’interno della nicchia, in modo da sviluppare terapie avanzate capaci di eliminare definitivamente la malattia.
Questo studio sarà svolto dai ricercatori dell’Unità Cellule Staminali diretta dalla dottoressa Marta Serafini, attraverso un costante confronto con i medici del Centro Maria Letizia Verga, reparto di onco-ematologia pediatrica. Inoltre, il progetto si avvarrà di collaborazioni scientifiche nazionali e internazionali.
Project Leader: Dott.ssa Marta Serafini
Responsabile Unità Cellule Staminali, Centro Ricerca M. Tettamanti
SCARICA LA SCHEDA PROGETTO

Il trapianto di cellule staminali ematopoietiche (HSCT) è il trattamento di scelta per numerose malattie ematologiche, tumori solidi e immunodeficienze. Purtroppo, la sua ampia applicazione è limitata dall’insorgenza di diverse complicazioni, tra cui la malattia del trapianto verso l’ospite (GVHD) che rappresenta la prima causa di morte a seguito dell’HSCT.
Anche se nel corso degli ultimi trent’anni il rischio di insorgenza di GVHD è stato ridotto modificando le procedure di preparazione al trapianto e la fonte di cellule staminali, parecchie sfide rimangono ancora aperte. La maggiore speranza per l’avanzamento in questo campo è rappresentata dallo sviluppo di trattamenti innovativi per la cura della GVHD, ottenibile attraverso una migliore comprensione delle basi patogenetiche della malattia e attraverso l’identificazione di nuovi marcatori di malattia, facilmente misurabili, capaci di predire l’insorgenza della stessa e la risposta alla terapia.
Sulla base di queste ipotesi, il progetto si compone di due linee di ricerca:
Questi studi saranno possibili grazie alla dedizione del gruppo di ricerca della dottoressa Giovanna D’Amico insieme al team medico del centro trapianti. Solo una visione comune e la stretta collaborazione potranno aiutare i biologi e i medici a trovare nuovi trattamenti per sconfiggere la GVHD e liberare il bambino trapiantato da questa temibile malattia.
Project Leader: Dott.ssa Giovanna D’Amico
Responsabile Unità di Immunologia ed Immunoterapia, Centro Ricerca M. Tettamanti